| 5-2 エントロピー | ||
| f-denshi.com [目次へ] 更新日: 08/08/18 | ||
| サイト検索 | ||
[1] カルノーサイクルにおける前ページの結論[#]をもう一度書いておくと,
Q1 + Q2 =0 ・・・・・ [*] T1 T2
これはQ=0である断熱曲線上も含めたすべての経路についての計算として,
| Q2 | +0+ | Q1 | +0 = | A→B | d'Q | + | B→C | d'Q | + | C→D | d'Q | + | D→A | d'Q | |||||
| T2 | T1 | T | T | T | T |
| = | カルノーサイクル | d'Q | = 0 | |
| T |
と書き直すことができます。つまり,サイクルの途中で熱の出入りがあれば,その熱量Q(受け取るとき正とする)をそのとき接触している熱源の温度Tで割り,これをサイクル1周について足し合わせるとその値はゼロとなるというものです。
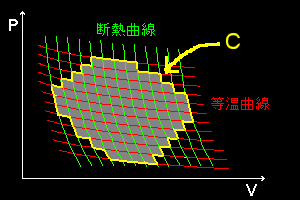 この[*]式は,カルノーサイクルの寄せ集めに分割して考えることのできるような任意の可逆サイクルへ拡張することできます。右図に示したような互いに共通の断熱曲線,等温曲線を介して隣接するn個のカルノーサイクル(=灰色の部分)を考えると,黄色で示した一番外側を構成する経路を除いた内部では,膨張過程と収縮過程の経路が隣接するカルノーサイクルどおしで打ち消しあうため,黄色で示した周辺部分(=ループC)だけがn個の総和を考えたときの正味の経路ということになります。そして,n個のカルノーサイクルの熱の出入りについては,
この[*]式は,カルノーサイクルの寄せ集めに分割して考えることのできるような任意の可逆サイクルへ拡張することできます。右図に示したような互いに共通の断熱曲線,等温曲線を介して隣接するn個のカルノーサイクル(=灰色の部分)を考えると,黄色で示した一番外側を構成する経路を除いた内部では,膨張過程と収縮過程の経路が隣接するカルノーサイクルどおしで打ち消しあうため,黄色で示した周辺部分(=ループC)だけがn個の総和を考えたときの正味の経路ということになります。そして,n個のカルノーサイクルの熱の出入りについては,
Q1 +・・・+ Qm = 0 ・・・・・ [**] T1 Tm
が成り立っています。ここで,分割数nを無限大とすると同時に分割されたひとつ一つのカルノーサイクルのサイズを無限小とする極限を考えると,閉曲線C上の線積分を用いて,[**]式を,
d'Q =0 可逆 T
と書くことができます。ここで,閉曲線Cは個々のカルノーサイクルの組み合わせによって任意の形状にできることに注意してください。つまり,(d'Q/T)なる量は
「 任意の閉じた経路でのループ積分が0となる。」(ここでのループは熱力学状態をあらわす曲面上になければなりません。)
ことを示しています。ベクトル解析の知見[#]よると,このような状況を満たす領域(今の場合,各座標軸がP,V,Tである3次元部分空間を考えます。この空間の点A とは,熱力学状態:(PA,VA,TA )を意味する。 )では,いわゆるポテンシャル関数が存在し,任意の2点AからBへの(d'Q/T)の線積分は始点と終点だけで決定されます。その ”ポテンシャル関数” を S とすれば,点AからBまでの積分は,
d'Q = S(B)−S(A) 可逆 T
と表すことが可能です[積分形]。ここで,S(B),S(A)はそれぞれ,点B,または点Aだけで定まる量なので「状態量」[#]です。このSをエントロピーといいます。
| さらに,S(B)−S(A)= | 可逆 dS なので微分形は, | |
|
と書くことができます。d'Q(可逆)は可逆な過程で発生(吸収)する熱量であることを忘れないように「(可逆)」をつけました。このように熱力学においてエントロピーはきわめて数学的な技巧として導入されます。したがってその技巧(数学)を理解することがどうしても必要です。(ベクトル解析の知識は不可欠なのでクリックは忘れずに ⇒[#])
なお,直感に結びつくようなエントロピーの物理的解釈は統計力学を学ぶ必要があります。(しかし,熱力学の構築にはエントロピーの統計力学的な知識は必要ありません。)
[2] ここでは次のことを強調しておきましょう。
第一にエントロピー(の変化)は可逆な過程で移り変われる状態変化に対して定義される(計算可能)ということです。エントロピーというと,次章で述べることになる自然現象の不可逆性を説明する熱力学第2法則との関係で語られることが多いので勘違いしている人も多いのですが,上の定義でみたように,エントロピーの変化量は,
「可逆な(準静的な)過程で状態変化した場合にだけ”計算”できる量」
なのです。したがって,
「エントロピは第2法則とは関係なく定義できる量」
です。実際,私は第2法則の中身についてまだ一言も述べてないにも関わらず,エントロピーの定義に関して話さなければならないことはもうすべてあなたに授けています。そして,あなたがこのページを最後まで読めば,簡単な状態変化に伴うエントロピー変化を計算できるようになるはずです。熱力学第2法則を知らないまま。
第二として,エントロピーは状態量だということです。ということは熱力学状態が指定されれば,それに対応するエントロピーの値を定めることができるということです。たとえば,始状態A,終状態Bの2つの平衡状態を考えたとき,その状態間のエントロピーの差はどのような過程でAからBへ移ったか(可逆的か不可逆的かに)は無関係に唯一定義することが可能な物理量です。
これは先の主張と矛盾していることを言ってるようですが,誤解のないよう先程の主張「 」を補うと,「不可逆過程で状態が変化した場合の熱の出入り,d'Q(不可逆)は可逆的な場合の d'Q(可逆)とは異なる値であり,この d'Q(不可逆)/T を用いてはこの過程にともなうエントロピー変化を算出できない。」ということです。
ちょっと休憩。
スイカはエントロピーだというお話
第一章の用語の説明の処で,「状態量」と「過程の量」の違いについて例え話をしました。再掲すると,
「 もし,熱力学状態を鉄道の駅に例えると,各駅の標高は状態量です。どうやってその駅にたどり着いたかには関係なく,駅を一つ指定すれば唯一定まる量だからです。他方,駅から駅へ移動するために必要な運賃は過程の量です。出発駅と到着駅の両方とその経路を指定しないと値が定まりません。東京から名古屋へ行くための運賃は,どのルートで行くか,何に(各停,新幹線,特急)乗って行くかで違ってしまうからです。
状態量の微小変化は微分記号を用いて,dS,dP,・・・ のように書きます。一方,過程の量の微小量は,d'W,d'Qというように d' という記号を慣用的に使います。その理由を先ほどの例を用いて説明すると,駅と駅との距離を小さくとったとき,状態量である標高差は小さくなるのに対して,過程の量である運賃は必ずしも小さくならないからです。つまり,東京から隣の有楽町まで行くための運賃が初乗り運賃だと決め付けるのは早合点であって,東京を出発し,松本を経由して名古屋に出て,そこから熱海,品川と経由して有楽町にやってくるときの運賃というのもアリだからです。つまり,過程の量とは数学的な微分量という概念とは馴染まないのです。だから, d という記号を使わないのです。それでもどうして小さな過程の量⇔少ない運賃(=130円)というものを考えたいときがあります。そのようなとき,d' という記号を使います。」
つまり,鉄道運賃は状態量ではないということです。ところで,本文中,過程の量である熱量Qに制限を加えることで,状態量であるエントロピーS を作り出せることをみてきました。ということは,それを真似して過程の量である運賃から何か状態量を作り出せないかと考えてみたくなります。実際に作ってみましょう。ポイントは準静的であることと可逆性です。準静的というところは特急や急行などは全部廃止して,鈍行列車だけとしたらよいでしょう。運賃が可逆的であるということは,払うだけではなく,逆方向に移動した場合は運賃の払い戻しをしてもらう必要があります。また,どんなルートであれ,一周して元の駅に戻ってきたらその「状態量」の増減はゼロでなくてはいけません。さあ,どんな運賃体系にしたらよいでしょうか。
こんなのはどうでしょうか。東京駅から各駅までの距離L(X)kmを求めておいて,A駅からB駅までの運賃を,100×{L(B)−L(A)}円 と決めるのです。つまり,A駅からB駅へ移動することで,もし10km,東京駅から遠ざかることになれば,100×10=1000円の運賃の支払い,逆に5km近づくことになれば,100×(-5)=-500円なので,500円の払い戻しを受けるのです。そうすれば,スイカカードの残高は状態量となります。つまり,任意駅を指定すれば,スイカカードの残高は駅ごとに一通りに決まるはずでしょう。この場合も具体的な残高を数値で示そうとするときは基準点をどこかに設けておかなければなりません。例えば,東京駅におけるスイカカードの残高は10万円としておけばいいでしょう。もちろん,基準点は必ずしも東京でなくても構いません。誰かJRに提案してみませんか?
[3] エントロピーの定義を述べたところで早速,前ページで考察したカルノーサイクルにおける等温膨張過程 A⇒B におけるエントロピー変化を計算してみましょう。この過程A⇒Bでは,
| −W1 = | PdV = | nRT2 | dV =nRT2log | VB | =Q2 | ||||||
| V | VA |
でした[#]。したがって,この過程におけるエントロピー変化は,
ΔSA→B = Q2 =nRlog VB T2 VA
となります。誤解があるといけないので,エントロピーの定義式に忠実な書き方も示しておきましょう。等温膨張過程A⇒Bでは,
−dW =PdV = nRT2 dV=dQ V
なので,
| ΔSA→B =S(B)−S(A) = | A→B | dQ | = | A→B | nR | dV=nRlog | VB | |||
| T2 | V | VA | ||||||||
なお,ΔSA→B =−ΔSC→D であることはいうまでもありません。
一方,カルノーサイクルにおける準静的な断熱膨張過程B→Cでは,外界とやり取りする熱量はdQ=0なので,そのときのエントロピー変化はΔSB→C=0 となります。同様に,ΔSD→A =0 であることもわかります。
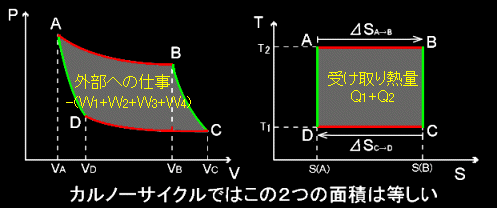
カルノーサイクルについて横軸にエントロピー,縦軸に温度をプロットしたS-T図を書いてみると下図のような長方形となります。比較のためにP-V図もその左に再掲してます。このとき,
W1+W2+W3+W4+Q1+Q2 = 0
であることを思い出せば,この2つの閉じた軌跡に囲まれた面積は等しいことがわかります。
これは可逆なサイクルに一般化できて,
− dW = dQ ⇔ PdV = TdS
と書くことができます。
また,ボイルの法則PAVA=PBVBから,
ΔSA→B =nRlog PA ← 以前,nRlog が抜けていたので訂正 PB
と状態A,Bの圧力を用いてエントロピー変化を表すこともできます。
ここで,「あれ,何か変だぞ?」と感じて欲しいことが一つあります。サイクル全体としては高温から低温へ熱が移動するカルノーサイクルにおいてエントロピーが変化する過程は,温度変化の起こらない等温過程においてであって,温度変化が生じている断熱過程ではエントロピーが変化していないというところです。これはエントロピーの本質が何であるか考えさせられる結果です。エントロピーの本質が単純な高温から低温へ熱の移動ではないことがわかりますね。
[1] エントロピーの具体的な計算例を他にもいくつか示した方が理解の助けになることと思いますが,その前に熱力学第一法則:dU=d'Q−PdV をエントロピーを用いた状態量で書き直しておきましょう。つまり,この d'Q に TdS を代入して,
dU = TdS−PdV
一方,エンタルピー変化は,
dH = dU+PdV+VdP = d'Q+VdP
と書ける[#]ので,
dH = TdS+VdP
と書くことができます。 これらは熱力学第一法則の別表現と見ることができますが,しばしば,具体的なエントロピーの計算をする際に使われます。
では,理想気体について,具体的なエントロピー変化について計算してみましょう。
[2]
(1) 等積温度変化 (dV=0,T1→T2)
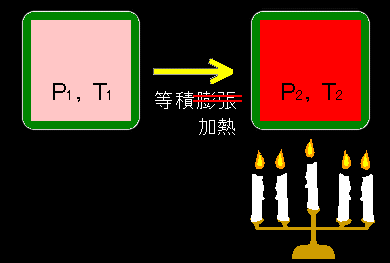 1モルの理想気体を体積を一定のまま,外部から熱を加えて(奪い),温度をT1からT2 [K] にしたときのエントロピー変化を計算してみましょう。先ほど求めたばかりの熱力学第一法則より,
1モルの理想気体を体積を一定のまま,外部から熱を加えて(奪い),温度をT1からT2 [K] にしたときのエントロピー変化を計算してみましょう。先ほど求めたばかりの熱力学第一法則より,
TdS=dU+pdV
=CvdT+0
よって,
dS=Cv dT T
始状態1から終状態2まで,両辺を積分して,
ΔS1→2 = Cvlog T2 T1
理想気体であれば,P1/T1=P2/T2なので,
ΔS1→2 = Cvlog P2 P1
と圧力を用いて書くこともできます。要するに,等積下で温度が上昇したり,圧力が増加すれば,エントロピーは増大するのです。
(加熱の途中,容器内で熱分布や対流が起きた場合は,内部が完全に均一となるまで待ってからP2,T2を測る必要があります。)
[3]
(2) 温度の均一化現象 (dV=0, 容器1:T1→(T1+T2)/2,容器2:T2→(T1+T2)/2
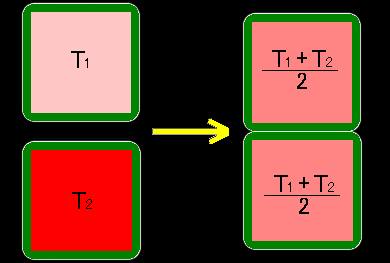 始状態1として,同じ2つの透熱容器に入った温度T1と温度T2にある2つの1モルの理想気体を考え,これらを接触させて平衡状態(=終状態2)に至らせ,このときのエントロピー変化を考えます。計算は直接,接触させた2つの容器の間での熱の移動を利用するのではなく,
始状態1として,同じ2つの透熱容器に入った温度T1と温度T2にある2つの1モルの理想気体を考え,これらを接触させて平衡状態(=終状態2)に至らせ,このときのエントロピー変化を考えます。計算は直接,接触させた2つの容器の間での熱の移動を利用するのではなく,
「(I) 各容器の温度をそれぞれ独立に平衡温度(T1+T2)/2に至らせ,(II) その後に容器を接触させる」
という2ステップの過程を考えてエントロピー変化を計算します。まず,(I)のエントロピー変化は(1)と同様に考えて,それぞれの容器について,
容器1 : ΔS(1)1→2 = Cvlog (T1+T2)/2 T1
容器2 : ΔS(2)1→2 = Cvlog (T1+T2)/2 T2
と計算できます。次に容器を接触させると最終状態2となりますが,その際のエントロピー変化は起こりません。つまり,(I)で求めた各容器中でのエントロピー変化の単純和が求めようとしている全エントロピー変化で,
ΔS(1)1→2 +ΔS(2)1→2 = Cvlog (T1+T2) +Cvlog (T1+T2) 2T1 2T2
= Cv log (T1+T2)2 4T1T2
となります。
[4]
(3) 定圧膨張変化 (dP=0, V1→V2)
TdS=dH−VdP = dH = CpdT
さらにシャルルの法則 V1/T1=V2/T2 も利用して,
ΔS1→2 =Cp dT =Cplog T2 =Cplog V2 T T1 V1
もちろん,定圧収縮する場合もそのままこの式が成立します。
[5]
(4) 等エンタルピー圧力変化 (dH=0, P1→P2)
等エンタルピー変化の具体例についてはジュールトムソン効果[#]を参考にしてください。
TdS=dH−VdP =−RT dP P
よって,
dS =−R dP P
状態1から2まで積分して,
ΔS1→2 = −Rlog P2 P1
圧力が低下する場合は,P2<P1 なので,エントロピーは増加することがわかります。 (終わり)
ところで,以上の理想気体の具体的なエントロピー変化の計算を通して,どのようなときにエントロピーが増大するかわかりますか?結果をまとめた一覧表を眺めてみてください。
| 変化 | 温度 | 圧力 | 体積 | 熱量 |
| 等温可逆膨張 | 0 | 低下 | 増加 | 流入 |
| (1) 等積加熱 | 上昇 | 上昇 | 0 | 流入 |
| (2) 温度均一化 | 上昇&降下 | 上昇&降下 | 0 | 0 |
| (3) 定圧膨張 | 上昇 | 0 | 増加 | 流入 |
| (4) 等H変化 | 0 | 低下 | 増加 | 0 |
さっぱり,わからないでしょう?正解は次のページへ進まないとわかりせん。
くどいようですが,ここまでまだ熱力学第2法則の話は全くしていません。
エントロピーの定義に必要なことは,熱力学第1法則と準静的な過程という概念だけ
です。熱力学第2法則とはまったく関係ありません。極論すれば,このページでやったことは,
d'Q(可逆) =dS T
によって,変数 Sを定義しただけです。したがって,熱力学体系を示すという目的だけならば,この一行だけでこのページを済ませて話を先へ進めることも可能です。次ページからはいよいよ本格的にエントロピーが登場し,大活躍していきます。
[目次へ]