| B2 ネルンストの式 | |
| f-denshi.com [目次へ] 更新日: 09/1/17 | |
化学平衡論の重要な応用です。
[1] 右図のような電極上の酸化還元反応を考えます。その化学反応は電気化学的に可逆であって次のように表されるとします。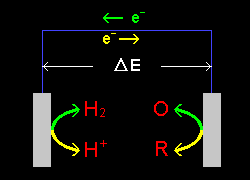
|
左の電極上: 水素ガス=H2 ⇔ プロトン=H+
右の電極上: 還元種=R ⇔ 酸化種=O
実際は電池を組んで行う実験ですが,電極上の反応と十分大きな抵抗につながっている外部回路だけに着目して考えます。水素ガス,プロトンは水溶液中に溶解している状態を考えます。また,還元種,酸化種は水溶液中であっても固体でも構いません。銅の酸化還元反応であれば,還元種は電極上の固体金属銅Cu,酸化種は水溶液中の銅イオンCu2+ということになります。
[2] このとき,(1)式に従いゆっくりと右方向に自発的に進行したときの自由エネルギー変化[#]をΔGとすれば,これは両電極間に発生しているセル反応の起電力ΔE [#](=開路電圧とも言います。)のもとで n モルの電子が外界に行う仕事に等しい,すなわち,
[電池のエネルギー減少量|ΔG|]=[外部に放出される電気エネルギー nFΔE ]
となるはずで,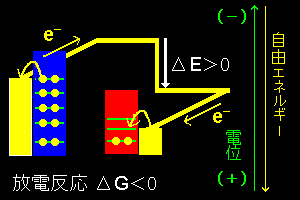
ΔG =−nFΔE ・・・・(2)
が成り立たなければいけません。(−)の符号は右へ向かう正反応が自発変化で,ΔG<0 のとき,ΔE>0 と定義されているので必要となります。また,F はファラデー定数です。(念のため補足しておくと左方向へ向かう反応が自発的となる場合もこの符号はこれでよい。なお,この式が実際の電池で正しく成り立つのは電流を0に近づけた極限においてだけです。それは内部抵抗と呼ばれる電池内部における様々なエネルギーロスが電流が大きくなるにつれて無視できないからです。)
一方,質量作用の法則によると[#],ΔGは標準自由エネルギー変化ΔG0 とそれぞれの電極表面の化学種の活量 aH2, aH+ ,aR, aO を用いて,
ΔG = ΔG0 + RTln (aR)nR・(aH+)n ( = −nFΔE ) (aH2)n/2・(aO)nO
と書けるので,これに(2)を代入すると,
ΔE = − ΔG0 − RT ln (aR)nR・(aH+)n ・・・・・ [*] nF nF (aH2)n/2・(aO)nO
が得られます[#]。さらにすべての活量が 1 のとき,すなわち,これを標準状態における起電力と呼んで, ΔE0 と書くことにすれば,ΔE0 = -ΔG0/nF なので,[*]は,
ΔE = ΔE0 − RT ln (aR)nR・(aH+)n nF (aH2)n/2・(aO)nO
と書けることがわかります。特に水素ガス,プロトンの活量が1( aH2=aH+=1 )の条件下では,起電力は
ΔE = ΔE0 + RT ln (aO)nO [ ネルンスト の式 ] nF (aR)nR
となります。
[3] 理論上は任意の酸化還元反応: R/O [ 活量:aO=aR=1 ] について,対極に活量が1の水素/プロトン水溶液( aH2=aH+=1 )の酸化還元反応を組み合わせた電池を考えることができます。その電池の起電力:ΔE
= ΔE0 を R/O の標準酸化還元電位(または標準電極電位)と定義します。これまで起電力(電位差)ΔE と呼んでいたものをここで ”電位”
と呼ぶことには少し注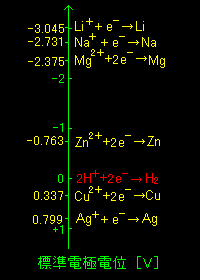 意が必要でしょう。電位と呼ぶ理由は電気化学では電位の基準として,
意が必要でしょう。電位と呼ぶ理由は電気化学では電位の基準として,
「 0 V の電位として活量 1の H2/H+(aq.) の酸化還元電位を採用する。」
からです。つまり,(1)で表した電池(すべての活量は1とする)の起電力の値(= ”電位差” )はそのまま R/O の ”電位” の値と一致しているのです。そこで,ネルンスト の式でのΔE のΔを省いて単に,E,および,E0 と書くことにしましょう。
ΔE0 ⇒ E0 [ 標準電極電位 ]
もう一つ注意があります。これまでの議論では(1)が右側に進む反応を自発的な反応と想定したような議論を進めてきましたが,あらゆる物質を対象とするときには当然,その逆の左側へ進行する反応が自発反応であるケースが出てきます。そのような場合は自然な拡張として,ΔE0,すなわちE0のとる値がマイナスであると解釈することにします。
[4] ネルンストの式では変数として活量が用いられていますが,実験系ではいつも活量(活量係数)が既知であるとは限りません。そのような場合,変数として電極表面上の化学種の濃度,CR,COを用いる方が便利です。還元種R,酸化種Oの活量を活量係数を用いて,
(aR) = γRCR, (aO) = γOCO
とあらわすと,
E = E0 + RT ln {γOCO}nO nF {γRCR}nR
= E0 + RT ln γOnO + RT ln COnO nF γRnR nF CRnR
と書けます。黄色の部分を = E0’ とおいて式量電位 といいます。すると,電極電位は,
E = E0’ + RT ln COnO nF CRnR
となります。
[5] さらに各電極上の反応(1)が平衡状態にある(みかけの電流がゼロ=外部回路の電流=0)では,電極表面の酸化還元種の濃度はバルク濃度[ CO*,CR* ]に等しいはずです。そのときの電位を Eeq (平衡電位)とすると,すぐ上の式から,
Eeq = E0’+ RT ln CO*nO nF CR*nR
これが平衡電位,Eeq と式量電位, E0’ との関係です。
まとめ
(1) 標準電極電位: E0
(2) 式量電位: E0’= E0 + RT ln γOnO nF γRnR
(3) 平衡電位: Eeq = E0’+ RT ln CO*nO nF CR*nR
SUSTAINABLE TOKIWADAIGAK SINCE 2002