| B1 電極反応 | |
| f-denshi.com [目次へ] 更新日: 04/10/16 | |
 |
| ダニエル電池 |
 |
 |
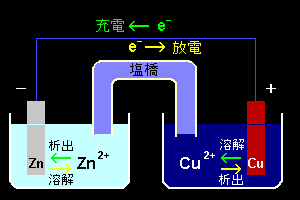
[1] 右図は単純な構造をした電池のひとつ,ダニエル電池の模式図です。
負極は,硫酸亜鉛水溶液(aq ZnSO4)に浸した亜鉛(Zn)
正極は,硫酸銅水溶液(aq CuSO4)に浸した銅(Cu)
から構成されていて,これらの溶液を塩化カリウム(KCl)溶液の満ちた塩橋[#]でつないでいます。この電池構造は次のような記号で表されます[#]。
Zn/ZnSO4//CuSO4/Cu
[2] この電池の正・負極からリード線を導いて抵抗につなぐと電流が取り出せます[放電]。このとき,電極表面では,
負極: Zn → Zn2+ +2e- [亜鉛の溶解]
正極: Cu2+ +2e- → Cu [銅の析出]
という反応が起こります。(このような電気化学反応にともなって酸化・還元される物質(金属,有機・無機化合物)を活物質と言います。)
また,放電にともなって各溶液(電解液)の電気的中性を保つよう塩橋を通じて正負イオン(K+,Cl-など)が移動します。(詳しいイオン移動の様子は後ほど[#]議論します。)
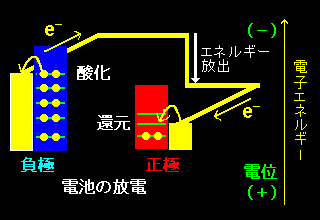
[3] 電池の両極に現れる電圧の大きさは,各金属電極からリード線に流れ込もうとする電子のもつエネルギ−(フェルミレベル)の差と理解できます。このエネルギーレベルは電極電位とよばれ (電極電位の正確な定義は次ページ,ネルンストの式参照のこと),流れる電流が十分に小さいときは電極表面の酸化還元反応にともなうギブス自由エネルギー変化と関係付けられます(→[#])。
この電池を抵抗につないだときに亜鉛負極から銅正極に電子が流れる(電流はこの逆方向)のは亜鉛電極中の電子の方が銅中の電子より高いエネルギーを持っているために電子は銅電極の方へ流れ込みます。
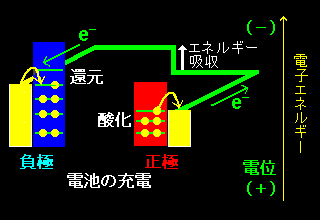
[4] ダニエル電池は放電のときとは逆方向に電流を流し,充電することも可能です。このような充電可能な電池を2次電池といいます。充電の時は低いエネルギーにある正極の電子を充電器によって高いエネルギー状態にもち上げて,負極の方へ強制的に流し込みます。電池内部でおこる現象は放電のときとはちょうど逆になります。
[5] 電極が金属の場合,電池の電圧はその金属によってほぼ決まっており,放電の途中でほとんど変化しませんが,一般的な有機化合物 (例:ポリアニリン) や無機化合物 (例:二酸化マンガンなど) からなる電極では,放電が進行するにつれて化学組成が変化し,放電電圧も変化するのが普通です。
[6] 電池反応の放電反応 (=もしくは一般の自発的に起こる酸化還元反応) が,
Zn + Cu2+ → Zn2+ + Cu
のとき,
(1)セル構造表記法(規則) ⇒ 左に酸化反応 & 右に還元反応 する物質を書く!
( -0.763 V ) Zn / ZnSO4 // CuSO4 / Cu ( 0.337 V )
(2)セル反応の起電力 emf (=Erxn) ⇒ 左に対する右の電極電位 とする。
ΔErxn =0.337−(-0.763) = +1.1 V ←09/05/21 訂正
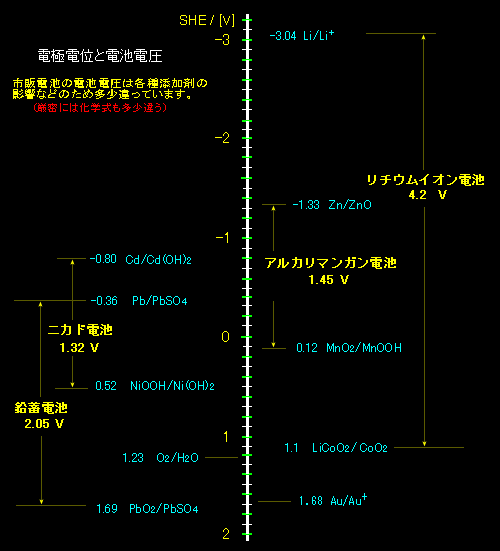
と定義します。このように定義すると右へ向かう自発変化(電池の放電)が起こるとき,必ず,ΔErxn>0となり都合がいいからです。もちろん,左右すべてを逆に定義してもよいのですが,世の中には右利きの人が多いので,業界の取り決めもこうなっています。たぶん。最後に主要な実用電池の起電力と電極電位を紹介しておきます。
[1] ダニエル電池では各電極上で充電時と放電時とではちょうど逆の酸化還元反応が起こり,電流も充電と放電とでは逆方向に流れます。したがって,(電池の)正極,負極という用語は電池の自発的に進む方向を示唆することはできても,いま,ある実験条件下での電流の方向 (=実際に起こっている電気化学反応) を示すことには役に立ちません。そこで電気化学では片方だけの電極に注目し,その表面で活物質が酸化されるのか還元されるのかに応じて次の用語を定義して用います。
還元反応 ⇒ [カソード反応といいます]
酸化反応 ⇒ [アノード反応といいます]
この用語を用いれば,
電池反応 正極上 負極上 放電 自発的反応 カソード反応
Cu2++2e- → Cuアノード反応
Zn → Zn2+ + 2e-充電 非自発的反応 アノード反応
Cu → Cu2++2e-カソード反応
Zn2++2e- → Zn
となります。(カソード析出,アノード溶出という用語もいっしょに覚えておきましょう。)ここで,非自発的反応というのは,電池だけを熱力学的な系とみなしてそう呼んでいるのであり,充電装置も含めて考えれば,実際に起こりえない反応が起こっているわけではありません。
[2] 実験上は電池反応のように正・負極上でカソード反応とアノード反応とがかならず対となって起こります。しかし,理論的な考察は一方の電極に着目して議論を行なう方が合理的です。ダニエル電池の例で言えば,亜鉛電極に注目して,
(1) 放電反応: Zn → Zn2+ +2e- [ 亜鉛の溶解/酸化 = アノード反応 ]
(2) 充電反応: Zn2+ +2e- → Zn [ 亜鉛の析出/還元 = カソード反応 ]
を考えて考察するわけです。このとき,相手方の電極で何が起こっているか考える必要はありません。亜鉛電極で起こる反応がアノード溶解なのか,カソード析出なのかだけが考察の対象なのです。このような見方を「単極反応を考察する」というような言い方をし,この講義でもそのような記述をしてゆきましょう。
[3] さて,電極反応の一般論を単極を用いて説明してみましょう(ここでは熱的なゆらぎ・状態分布は無視します)。電解液中に溶解している分子 Q が溶解したりすることのない電極表面で電子の授受だけを行い,酸化されて Q+,還元されて Q- になりうるような系を考えましょう。このとき,電極上でどのような反応が進行するかは単極(集電体)の電位を考えて予想可能です。すなわち,電極電位(集電体中の電子エネルギー)が分子 Q の
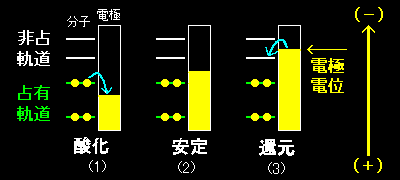 (1)分子の最高占有軌道にある電子のエネルギーより低いとき(電極がよりプラスを帯びているとき)
(1)分子の最高占有軌道にある電子のエネルギーより低いとき(電極がよりプラスを帯びているとき)
⇒ Q+ が生成する(アノード反応)
(2)分子の最高占有軌道にある電子のエネルギーと最低非占有軌道にある電子のエネルギーとの間にある場合,
⇒ Q のまま変化は起こらない
(3)分子の最低非占有軌道にある電子のエネルギーより高い場合(電極がよりマイナスを帯びているとき)
⇒ Q- が生成する(カソード反応)
単極で起こる反応は電極電位と電気化学的に活性な物質(活物質)のエネルギー準位(またはフェルミレベル)さえがわかれば予想可能なのです。
(マクロな数の分子が集まってなる現実の系では,熱力学的分布を考える必要があり,上の3つの状態はポテンシャルの変化に対して連続的滑らかに変化します。)
SUSTAINABLE TOKIWADAIGAK SINCE 2002
もし,系の体積変化があるときの体積仕事以外の仕事,たとえば,電気的仕事などをd'wとすると,
d'Q = dU −d'W ≦ TdS
d'W =d'w−PdV
の2式より,
−d'w ≦ TdS−dU−PdV=−dG
つまり,ギブス自由エネルギー変化は体積仕事を除いて取り出せる最大仕事の目安となる。