| 15 溶液論へ(2)浸透圧 | ||
| f-denshi.com [目次へ] 更新日: 03/06/07 | ||
| サイト検索 | ||
前章では溶質が液相だけに溶媒と共存し,溶媒分子は液相の他に気相,または固相にも存在可能なケースを考えました。ここではその逆,すなわち,溶媒は液相にのみに存在し,溶質が液相と他の相(気相,もしくは固相)の両方に存在するケースを考えます。具体的には気相の酸素の一部が微少量だけ水に溶け,密閉容器の中で平衡状態にあるような状況を思い浮かべるとよいでしょう。
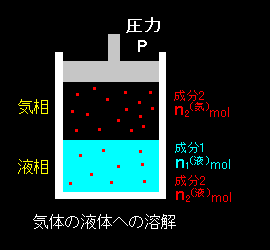 [1] 気液共存状態において,溶液相の溶質だけが気相にも存在できる場合を考えます(右図)。
[1] 気液共存状態において,溶液相の溶質だけが気相にも存在できる場合を考えます(右図)。
溶媒を成分1,溶質を成分2とし,右図のようなモル数が気相,液相に存在して平衡状態にあるとします。また,液相の溶質のモル分率を
x2=n2/(n1+n2) とします。ここで,平衡状態では,溶質の化学ポテンシャルは気相と液相とで等しくなければいけないので,
μ20(気)(T,P)=μ20(液)(T,P,1,0)+RTlog x2
が成り立ちます[参照せよ⇒#]。この式を P で偏微分すると,
∂μ20(気)(T,P) = ∂μ20(液)(T,P,1,0) + RT ∂log x2 ∂P ∂P ∂P T
熱力学関数の公式(12)[#]を使って,
v~20(気)(T,P)=v~20(液)(T,P,1,0)+ RT ∂log x2 ∂P T
また,平均モル体積について,v^20(気)=v^20(気)>>v~20(液)なので,v~20(液)=0と近似して,
(↑ v20(液) は気体が溶媒に微小量溶けたために起こる体積変化(モルあたり)です。)
∂log x2 = v20(気)(T,P) = 1 (←理想気体と仮定して) ∂P T RT P
となります。ここで,Pは気体の圧力です。この式をPに関して積分して,
logx2=logP+log f(T) ← いま,T,Pの2変数関数として考えてます。
ここで,log f(T) は積分定数で,温度のみの関数です。したがって,
x2=f(T)・P ; f(T) は任意のT の関数
となります。つまり,「液体に溶けこむ気体の量は圧力に正比例する。」ことがわかりました。これをヘンリーの法則といいます。
[2] この結果は,理想気体-理想溶液の2成分2相共存系の一般的議論の結果より直接得ることもできます。もう一度,11.で求めた2成分2相共存条件[#]を書くと,
P (x2) = P1+(P2−P1)x2 液相の圧力-組成曲線
P (y2) = P1P2 気相の圧力-組成曲線 P2+(P1−P2)y2
となりまが,ここで気相には(ほとんど)成分2しか存在しないのであれば,y2=1,および,P2>>P1 ≒0 という条件をつけることになります。そのとき,上式は,
P (x2) = P2x2 液相の圧力-組成曲線
P (y2) = P2 気相の成分2の分圧=ここでは全圧
1番目の式でP2は今,考えている温度における純成分2の飽和蒸気圧で,温度のみの関数です。したがって,1番目の式はヘンリーの法則に他なりません。
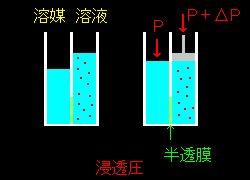
[1] 溶媒だけが行き来できる半透膜を介して,その純溶媒とその溶媒に溶質を溶解させた溶液とを接触させると,溶媒が純粋な溶媒の側から溶液の方へ移動して行きます。それを阻止するためには溶液側に純溶媒側の圧力Pより大きな圧力P+ΔPをかけてやらなければなりません。この余分な圧力ΔPを浸透圧といいます。この現象は溶液の濃度に関係なく見られますが,ここでは希薄溶液ついての定量的な考察を行ないます。
[2] 溶液中の溶媒(成分1)と溶質(成分2)のモル数をそれぞれ,n1,n2とします。溶媒に対して,純溶媒相と溶液相の化学ポテンシャルが等しいとして,
μ10(純)(T,P )=μ10(溶)(T,P+ΔP,1,0 )+RTlog (1−x2 )
この式を近似して,
−x2≒ μ10(純)(T,P) − μ10(液)(T,P+ΔP,1,0) RT RT
↓ 圧力Pの周りで展開して[#],
| ≒ | μ10(純)(T,P) | − | μ10(液)(T,P,1,0) | + | ∂ | μ10(液)(T,P,1,0) | ΔP | ||||
| RT | RT | ∂P | RT |
↓ 上式で,μ10(純)(T,P),μ10(液)(T,P,1,0) とを区別する意味がないことに注意して,
=− ∂ μ10(液)(T,P,1,0) ΔP ∂P RT
↓ 熱力学関数の公式(12)[#]を使って(μはGに対応),v~10(純)=v10(純)と近似して,
= − v10(液)(T,P,1,0) ΔP RT
ここで,v10(液)(T,P,1,0)は溶液側の溶媒のモル体積。
[3] よって,溶液中の溶媒のモル数をn1として,
x2RT=v10(液)(T,P,1,0 )ΔP
↓ n1を両辺にかけて
n1x2RT=n1v10(液)(T,P,1,0 )ΔP
ここで,
n1x2=n1n2/(n1+n2) → n2 ( 希薄溶液なので,n2<<n1 )
n1v10(液)(T,P,1,0) → V ← 溶液の溶媒の体積≒溶液の体積
と近似すると,
n2RT=VΔP
となります。さらに,浸透圧と呼ばれるΔP をΠと記号を換え,溶質のモル数n2をnと書き直せば,
| 浸透圧のファントホッフ則 溶媒だけを通す半透膜を介して希薄溶液と純溶媒が接しているとき,純溶媒から希薄溶液側への溶媒の浸入を防ぐために必要な圧力:Πは, で与えられる。ただし,C:希薄溶液のモル濃度。 |