| 7 熱平衡の条件 | ||
| f-denshi.com [目次へ] 更新日: 08/6/19 | ||
| サイト検索 | ||
いよいよこのページから熱力学を化学や物性物理へ応用するための話が始まります。まず,森羅万象すべての現象に対して適用されるべき熱力学第1法則と熱力学第2法則を組み合わせるとどのような結論が導かれるかの一般論を展開します。特に系に等温条件が課されたときの熱平衡条件を考察し,新しい熱力学関数として,ヘルムホルツ自由エネルギーとギブス自由エネルギーを導入することがこのページの目的です。(ここで考えている系とはピストンつきシリンダ中の純粋気体に限定されない,複数の物質の関与する物理現象や化学反応を伴っても構わない系で,要するに何でもアリという一般的状況を考えます。シリンダの中の1種類の理想気体だけをイメージしていては,このページの内容は理解できない( or 理解に苦しむ)ので頭を切り替える必要があります。とりあえず,等温等積過程や等温定圧過程の具体的なイメージとしては2種類の理想気体の混合を考えるとよいでしょう。⇒[#]。)
 [1] 熱力学第2法則を認めると熱平衡状態の予測・判定が可能になります。熱力学第2法則によれば,孤立系とみなせる十分広い範囲(大風呂敷を広げるなら全宇宙)を含む系の状態が,
[1] 熱力学第2法則を認めると熱平衡状態の予測・判定が可能になります。熱力学第2法則によれば,孤立系とみなせる十分広い範囲(大風呂敷を広げるなら全宇宙)を含む系の状態が,
A0 ⇒ A1 ⇒ A2 ・・・・ ⇒ An
と自発変化してゆくならばそのとき,各状態における系のエントロピーは遂次増加しているはずで,
S0 ≦ S1≦ S2 ・・・・ ≦ Sn
という不等式を満たしていなければなりません。ということは,エントロピーを状態 Ak の関数として, S(Ak)と書くならば,関数 S(Ak)に極大を与える状態Amaxに達すると,系はもうそれ以上,自発変化が起こらないということができます。もし,状態Amaxの近傍の異なる状態Amax+εに変化しようとするとエントロピーが減少することになり,熱力学第2法則に反するからです。このような,それ以上,
「自発的に変化しない状態を熱平衡状態と呼ぶ。」
のでした。例えるならば,”状態” の動ける範囲と初期値を指定してやると,上を向いて登ることしか知らない ”状態” は上へ上へとエントロピーの山を駆け登り,最初に到達したピークで立ち往生することになる・・・ これが熱力学第2法則から予想される自然に起こり得る現象の帰結です。
[2] このような考察を状況に応じて定量的に取り扱うと,様々な熱平衡条件を導くことができます。まず,最も一般的な熱平衡条件は次のように言えるでしょう。
「系が平衡状態にあるときは,すべての仮想的な状態の変化について計算される系のエントロピー変化が熱力学第2法則に反する。」
式で書くと,
| 仮想的な状態の任意の変化(変分)について, δQ−TδS ≧ 0 ・・・・・・・・・・・・ [*] であるとき,その状態は熱平衡状態にある。 |
といえます。この式は,熱力学第2法則: dQ/T ≦ dS の不等号の向きを変えて,d の代わりにδと置き換えたものです。ここで,δという記号を使うのは変化量があくまで ”仮想的な変分量” であることを強調するために,d と区別して用います。この式があらゆる熱平衡条件を求めるための出発点となる式で,熱平衡平衡条件の判定基準(criterion)と呼ばれます。そしてこの[*]式に様々な条件をつけることでいろいろな条件付熱平衡条件が導出されます。
[3] まず,この不等式は熱の出入りのない(δQ=0)仮想的変化に対しては,
| δS ≦ 0 [ 断熱変化に対する熱平衡条件 ] |
を意味し,孤立系の熱平衡状態においては,すべての仮想的な状態変化に対して,エントロピーが減少する。つまり,その状態のエントロピーは極大値となっていることを示しています。(極大値と最大値とは同じ意味ではありませんぞ。)
[4] 次に熱平衡条件 δQ−TδS ≧ 0 を状態変数だけで表すために,δQ=δU+PδV [#] を [*] に代入してみましょう。すると,熱平衡条件として,
δU+PδV−TδS ≧ 0 ・・・・・・・・・・・・ [**]
が得られます。ここで条件,δS=δV=0 を課すと,
|
δU ≧ 0 [ 等エントロピー・等積変化に対する熱平衡条件 ] |
これから等エントロピー・等積変化しか許されないという条件下での熱平衡条件は,内部エネルギーが極小であるということができます。エントロピーの性質,すなわち,熱力学第2法則から出発し,内部エネルギーに着目した熱平衡条件が導かれました。
[5] 次に系になされる仕事が体積変化によるものだけのときは,エンタルピー変化は δH=δU+PδV+VδP と書けることを思い出しましょう[#]。この関係式と[**]からδU+PδV を消去すると,
δH −VδP−TδS≧ 0 ・・・・・・・・・・・・ [***]
ここで,δP=δS=0と条件を課せば,
|
δH ≧ 0 [ 等エントロピー・定圧変化に対する熱平衡条件 ] |
が等エントロピー,定圧変化における熱平衡条件となります。 一方,[**],[***]においてそれぞれ,δU=δV=0,δH =δP=0 とすれば,
| δS ≦ 0 [ 等内部エネルギー・等積変化に対する熱平衡条件 ] δS ≦ 0 [ 等エンタルピー・定圧変化に対する熱平衡条件 ] |
も示すことができ,これは孤立系の熱平衡条件と同じになります。つまり,エントロピー増大の法則が文字通り成り立つのは次のような条件となります。
| 拘束条件 | 一定とする 変数 |
熱平衡の条件 | 自発変化が 起こるとき |
| 断熱変化(すべての孤立系で) | Q | S が極大:δS ≦ 0 | dS ≧ 0 |
| 等内部エネルギー・等積変化 | U,V | ||
| 等エンタルピー・定圧変化 | H,P |
そしてこれらの条件が満たされない場合,必ずしもエントロピーが極大のところで熱平衡状態が達成されるわけではないということになります。そのような場合,もはやエントピーは熱平衡状態を記述する最良の指標とはならないのです。新しい熱力学関数を熱力学の舞台に引きずり出してこなければならない理由がここにあります。そのためには,ここまで直接議論しなかった温度という実験的制御が比較的容易な熱力学変数を熱平衡の議論の中心に取り込んでゆく必要があります。
[1] 温度・体積が一定の場合の熱平衡条件を考えましょう。
温度,体積一定の場合,熱平衡条件は一般的な熱平衡条件 [**] δU+PδV−TδS ≧ 0 を書きなおして,
(δU)T,V−T(δS)T,V ≧ 0
となります。もちろん,熱平衡条件としてこの表現でもOKですが,もっと簡潔に表現するために次のような状態量 F を定義します。
F = U−TS
この微小量を考えると,
δF =δU−TδS−SδT
T,Vを一定とするときは,
(δF)T,V=(δU)T,V−T(δS)T,V
これをもちいると,先ほどの不等式は,
| (δF)T,V ≧ 0 [ 等温・等積変化に対する熱平衡条件 ] |
と簡潔になります。このF をヘルムホルツ自由エネルギーといいます。この用語を用いると,温度,体積一定のもとで系が熱平衡にある条件はヘルムホルツ自由エネルギーが極小となることということができます。
一方,自発変化が起こるならば, (dF)T,V≦0ということができます。つまり,
自発な等温等積変化にともなって減少していく量としてヘルムホルツ自由エネルギーは定義されている
のです。
[2] ヘルムホルツ自由エネルギーには応用上,重要な意味があります。熱力学のもともとの関心事は熱機関に投入した熱をできるだけ多く ”使いものになる” 仕事(エネルギー) として取り出したいというところにありました。それではいったい理論的にどれくらいまで取り出し可能かというと,それは熱力学第一法則と熱力学第2法則とを組み合わせた式,
d'Q = dU −d'W ≦ TdS
を,
系が外へする仕事: −d'W ≦ −dU+TdS
と書き直してみるとわかります。左辺は系が外部へ行った仕事,右辺がその取り出せる仕事の限界(最大値)を示しています。この右辺をヘルムホルツ自由エネルギーを用いて書き表すと,
−d'W ≦−dF−SdT
となりますが,等温変化(dT=0)のときは,
| −(d'W)T | ≦ | −(dF)T | [等温変化] |
| (系が外部へする仕事) | −(ヘルムホルツ自由エネルギー変化) |
とできます。つまり,熱機関を(連続して運転するときには温度が上昇し続けたたり,下がり続けたりすることはないので)一定の温度下で連続運転するときに取り出せるエネルギーの最大値はヘルムホルツ自由エネルギー変化の値で制限されることがわかります。そのようなわけで F を別名,最大仕事関数といいます。もし,dFが負で自発変化が起きるときは,−dFは正の値となり,系が外部に対して行う仕事も正の値を取り得ます。しかし,dFが正であれば,決して−d'Wは正の値を取ることができず,外へ対して正の仕事を行うことができません。
さらに仕事d'W’を体積仕事−PdVとそれ以外の仕事d'W”とに分けて考えることにすれば,
-d'W”≦−dF−PdV =−(dF)T,V
となります。これから,等温等積変化 (dT=dV=0) においても,外部に取り出せる体積仕事以外の仕事はやはり,ヘルムホルツ自由エネルギーで制限されることがわかります。
[3] さて,等温-等積下で自発変化が起こるとき,条件付の熱力学第2法則からdF≦0でなければならないことを述べましたが,その際,系は外部に対して仕事を行える可能性があります。ではこのとき,エントロピーはどう変化するのでしょうか。エントロピーは増えることもあれば,減ることもあります。その様子を,(dF)T,V=(dU)T,V−T(dS)T,V に注意して分類すると次のようになります。
|
|
(a)の場合はdS=0でも構わない。 (b)の場合はdU=0でも構わない。 (c)の場合はdU,dSのいずれかが0でも構わない。 |
エントロピーが自発的変化によって増大するのは,あくまで断熱系での話であって,適当な条件下ではエントロピーが減少しながら,自発的な変化が進行していくこともあり得ます。この図は下にゆくほどヘルムホルツ自由エネルギーFが減少するように描いていますが,(a)の場合,dF<0となる推進力は内部エネルギーの減少によるもので,−TdSは正,すなわち,エントロピーは減少(dS<0)しており,自発変化を妨げる働きをしています。この分,系が外部に対して行える最大仕事(-dF)は減少しているのです。つまり,−TdSは,系から仕事として取り出すことのできないエネルギーとなっており,束縛エネルギーと呼ばれることがあります。ただし,この項がいつも取り出せないわけではなく,(b)のように外部に取り出せるエネルギーの主要部分となることさえもあります。エントロピーが仕事に変わる具体例として濃淡電池の放電反応を例としてあげることができます。(c)は内部エネルギーの減少とエントロピーの増加がともに自発変化に有利に寄与するという場合です。
(蛇足ですが,「dV=0 のとき,系から外へ仕事を取り出すことはできない」と考えたとしたら,それは早合点であって,容積一定の電池という系から電気エネルギーの形で外部にエネルギーを取り出し,その電気エネルギーでモーターを回せば,これも外部への仕事を立派にやってのけていることになるのです!ピストンの運動だけが仕事ではないのです。ただし,電池反応の熱力学は,化学平衡をとおして議論することになるので,ヘルムホルツ自由エネルギーではなく,次に説明するギブス自由エネルギーを用いて考察します。)
[1] 系の温度一定という条件にもう一つ圧力が一定という条件を付け加えて考えましょう。すなわち,等温(δT=0),定圧(δP=0)変化しか許されないときの熱平衡条件を求めます。生命現象も含む多くの系の変化が大気圧,室温の下で進んでいくことを考えるとこれはもっとも重要な条件です。一般的な熱平衡条件 [**]を書きなおして,
(δU)T,P+P(δV)T,P−T(δS)T,P = (δH)T,P−T(δS)T,P ≧ 0 ・・・・・[***]
と書くことから始めます。この不等式もギブス自由エネルギーと呼ばれる新しい熱力学関数 G を定義することで簡潔に書き直されます。すなわち,
G = U+PV−TS
= H−TS
を定義すると,
δG=(δU)+P(δV)+V(δP)−T(δS)−S(δT)
↓
(δG)T,P = (δU)T,P+P(δV)T,P−T(δS)T,P
=(δH)T,P−T(δS)T,P
すると,熱平衡条件[***]は,
| (δG)T,P ≧ 0 [ 等温・定圧変化に対する熱平衡条件 ] |
と簡潔に書き直せます。つまり,等温・定圧における熱平衡条件はその状態のギブス自由エネルギーが極小となっていることです。逆に自発変化が起こるならば,そのとき, (δG)T,P≦0ということができます。つまり,
自発的に進む等温定圧変化に伴って必ず減少していく量として,ギブス自由エネルギーは定義されている
のです。
ヘルムホルツ自由エネルギーの場合と同様な議論なので詳述は避けますが,等温・定圧変化において,dG=dH−TdSであることに注意して自発変化の起こる場合のギブス自由エネルギー変化を下図のとおり分類可能です。
|
|
(a)の場合はdS=0でも構わない。 (b)の場合はdH=0でも構わない。 (c)の場合はdH,dSのいずれかが0でも構わない。 |
ここでも dF を考えたときと同じように,ギブス自由エネルギー変化 dG に対するエントロピー項の寄与はケースバイケースであって,dGの温度依存性も正・負の両方が考えられます。しばしば,「自然に進む現象はエンタルピーとエントロピーのせめぎ合いによって決まる」というような言い方を聞きますが,それはこのような状況を指して言っているのです。(a)はエンタルピーの勝ち。(b)はエントロピーの勝ち。(c)はお前ら共犯だよ。というところかな?簡単な具体例として水がある一定の温度,圧力の下で可逆的に蒸発・凝集する現象を考えて見ます。そのとき,
dG蒸発=dH蒸発−TdS蒸発 ・・・・・[****]
が成り立っています。ここで,dG蒸発,dH蒸発,dS蒸発はそれぞれ,等温,定圧下で水が蒸発する際のギブス自由エネルギー変化,エンタルピー変化,エントロピー変化です。水が蒸発して水蒸気になるときは水の凝集力に打ち勝って蒸発するわけですからそのエネルギーを熱として系に加えなければいけません。つまり,dH蒸発>0です。また,蒸発によって,液体から気体になる際には体積が増加し自由度が増すため dS蒸発>0 であることもわかります。このことをふまえて,[****]式を見てみると,温度Tが低下していくと,マイナスの値をとる第2項の寄与はどんどんと小さくなり,ある温度を境に dG蒸発は正の値しかとらなくなります。したがって,そのような低温度領域での水の蒸発反応は起こりえないということができます。一方,その境の温度より高温領域では,第2項の寄与が第1項を凌駕し,dG蒸発<0 となっていることでしょう。そのような高温度領域で蒸発は自発的に起こると予想できます。もちろん,ここでいう境の温度とは沸点のことで,1atmでは100℃です。以上,大雑把な考察ですがエンタルピーとエントロピーとがせめぎ合う具体例です。詳しくはまた後ほど改めて考えます。
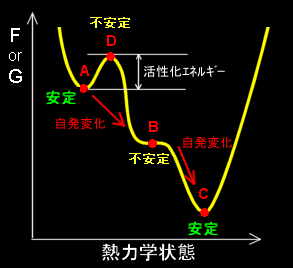 [1-2] さて,右の図を用いて熱平衡とその熱力学的安定性について吟味してみます。横軸は連続的に移り合える熱力学状態を表し,縦軸をその状態に対応するヘルムホルツ自由エネルギー,またはギブス自由エネルギーとしています。そして点A,B,C,Dは,系が互いに移り変われる自由エネルギーの第一変分δFが0,すなわち,その点でFまたは,Gが極値をとる可能性のある点です。これらの点が本当に極値をとるかどうかはさらに第二変分と呼ばれるδ2F,もしくはδ2G の符号を調べて見る[#]必要があります。第二変分が正,すなわち,下に凸となる点は,先の4つの点の中ではAとCであることがわかります。
[1-2] さて,右の図を用いて熱平衡とその熱力学的安定性について吟味してみます。横軸は連続的に移り合える熱力学状態を表し,縦軸をその状態に対応するヘルムホルツ自由エネルギー,またはギブス自由エネルギーとしています。そして点A,B,C,Dは,系が互いに移り変われる自由エネルギーの第一変分δFが0,すなわち,その点でFまたは,Gが極値をとる可能性のある点です。これらの点が本当に極値をとるかどうかはさらに第二変分と呼ばれるδ2F,もしくはδ2G の符号を調べて見る[#]必要があります。第二変分が正,すなわち,下に凸となる点は,先の4つの点の中ではAとCであることがわかります。
「熱力学的に安定な点AとCは熱平衡状態となり得る。」
と言えます。点Bの第二変分は0,点Dの第二変分は負であり,熱力学的安定点ではありません。実際に系がAとC,どちらの熱平衡状態に達するかは,系に与えられる初期条件に依存し,たとえば,最初に系がAとDとの中間あたりにあれば,Aが熱平衡状態として落ち着く点となります。これは,熱力学第2法則から導かれた,「自発変化がおきる場合,dG,dF≦0となる」ということからの帰結です。
しかし,もっと広い範囲で熱力学状態を考えれば,条件 dF≦0 を満たすことから,
A → B → C [自発的変化の方向]
という変化が自発的に起るということも可能です。つまり,十分な時間が経過すれば,Aにあった状態はB,さらにCへと変化することが自然な方向であると熱力学第2法則から主張できます。その意味では,「状態BはAより安定な状態」ということができますが,この場合の安定という用語は第二変分を用いて議論される熱力学安定性とは異なった意味で使われていることに注意しなければいけません。
なお,状態Bが状態Aより安定であるからといって,AからBへの変化が現実に観測できるかどうかは別問題です。熱力学第2法則がいうところの自発変化は,いわば時間が無限大経過した時の状況を述べているのであって,人間にとって現実的な時間経過後の状況を述べているわけではないからです。AからBへの変化にはDを通らなければいけませんが,DはAより,大きな自由エネルギーを持っています。したがって,活性化エネルギーとも呼ばれるAからDへ至るためのエネルギーが十分大きいときは,系はAの状態で立ち往生してしましい,AからBへの変化を実際に見ることはできないのです。実際,実験的にどちらの構造が本当に安定なのかよくわからなくて議論となることもしばしばあります。どれくらいの時間をかければどれくらいの確率でこの変化を観測可能かというようなことは平衡熱力学において予言することはできません。このような問題は反応速度論や量子統計力学の助けが必要となります。
禅問答をここで繰り広げるつもりはないので深入りしませんが,正確に言えばどんな平衡状態であろうと,系に含める範囲や時間を適当に大きくとれば,すべて不可逆現象の一瞬を見ているに過ぎないのは確かです。だからといってそんなことを理由に平衡論を一刀で切り捨ててしまうのでは身もフタもないことは言うまでもありません。
[2] 最後にこれまででてきた熱力学関数を用いて示される熱平衡条件をまとめておくと,
|
|
||||||||||||||||||||||||||||||||||||||||||||
| * 何も起こらない熱平衡状態も”現実に起こり得る変化”として自発変化に含めている。 | |||||||||||||||||||||||||||||||||||||||||||||
となります。具体的な熱平衡条件を求めるときの実際の数学的手続きは,δG=0 などとおき,必要条件を求め,十分条件については第2変分についてδ2G>0 を確認することとなります。詳細は,Appendix 3 熱平衡状態の安定性のところで確認してください。
ここでは,様々な拘束条件下での熱平衡条件が,それぞれ最適な熱力学関数を用いると簡潔に表されることを示しました。しかし,もう一度,よく思い出して確認して欲しいことは,いずれの熱平衡条件も,導出を遡ってたどり着く先は熱力学第2法則です。そう言った意味で,
「平衡熱力学において平衡条件を見出すとは,”エントロピー山脈” の頂きを探し当てること」
と言うことができるのです。なお,右側に再掲した ”ウガンダハイフンの図” と左のまとめの表をよく比較しておいてください。この図と比較することで,熱平衡条件に見られる美しい対称性を再認識できます。
T,P一定の下で起こる自発的変化の例として,大気圧下,恒温槽(オイルバスなど)中でゆるやかに自発的に進行する化学反応を挙げておきます。自発的に進む化学反応が発熱反応である場合,反応の進行によって(系の内部から)熱が発生しますが,その熱を外界である恒温槽に速やかに捨てることで,等温定圧下での自発的な反応が実現します。このとき,系のエンタルピーは減少し(反応熱:ΔH<0),その熱を受け取る外界であるオイルバスのエントロピーは -ΔH/T だけ増加します。その際,系のエントロピー変化をΔSとすると,系のギブス自由エネルギーは減少しなければならない ( ΔG=ΔH−TΔS<0 ) というのが熱力学の教えるところです 。この不等式を
-ΔH/T+ΔS > 0
と書き直すと,これは,
(外界のエントロピー変化)+(系のエントロピー変化) > 0
すなわち,系だけでなく外界も含めた全エントロピーを考えると,それは増大しなければならないと読み替えることもできます。このように解釈すれば,「ギブス自由エネルギー減少の法則」と「エントロピー増大の法則」とは等価であることがはっきりとわかります。
このページの議論は理想気体に限定した話ではなく,相転移が起こってもよく化学反応が起こっても構いません。シリンダーにつめられた水蒸気は液化してもよく,化学反応を起こして水素と酸素に分解してもよく,それらが電離してプラズマ状態になってもよいということです。そのような森羅万象,起こりうるすべての変化に対して,熱力学第一法則,熱力学第二法則が物理の基本法則として常に成立する(←これは原理として受け入れる類のもので証明は存在しない)ならば,熱平衡状態はどのように記述されるべきかまとめたのがこのページです。ただし,具体的に起きる現象をブラックボックス化して8つの熱力学変数(関数)だけで議論がなされています。
熱力学を理想気体から一般のすべての現象に拡大適用するときの注意点は,熱は外界との熱や仕事のやり取りを通して発生・消滅するだけでなく,「系の中で発生したり消滅したりすることもある」ことです。いわゆる「潜熱」を考えることが必要です。潜熱とは気化熱や反応熱,混合熱などのことです。これらは突き詰めて考えれば,物質のもつ静電ポテンシャルとして理解すべきものですが,平衡熱力学ではこれらを物質や化学反応に固有の定数として天下り的に受け入れます。そのことで実に多くの物理化学的現象が演繹的に説明されていくようすは化学熱力学の醍醐味であって,そのようないくつもの応用を通してのみ熱力学の「普遍性(=将来的にも例外は見つからない!)」を実感することができるように思えます。(11/3/12追記)