| 301 基本結晶構造 I | |
| f-denshi.com 更新日:05/02/10 | |
| サイト検索 | |
|
[1] 原子の規則性のある配列を結晶と呼ぶことにしましょう。 球を最小の体積を持つように空間に充填する並べ方を最密(充填)構造(Close Packed Structure)と呼びます。自然界に存在する金属結晶(最外殻電子が充填s軌道)の中にも最密構造を持った物質が多く存在し、金・銀・銅などもこの構造を持ちます。 最密構造は大きく分類すると2種類存在します。 この上に2層目(青色)を積みます。この第2層自身も最密に並んでおり、この置き方は一通りしかありません。 この第2層上に3層目の原子を積む際に原子の置き方は2通りあります。すなわち、1層目の原子の面内の位置をAと呼び2層目の原子の面内の位置をBと呼ぶことにすると、3層目の選択は第1層と同等の位置A(赤色)、または全く別の位置C(緑色)かの二つがあります。 ABC-ABC の周期 ⇒ 面心立方構造(fcc) と呼ばれています。他に見られる周期性としては、 ABAC-ABAC の周期 ⇒ ランタン型構造 ABCBCACAB-ABCBCACAB の周期 ⇒ α-Sm(サマリウム) などがあります。 |
 |
|
| 1層目(A) | ||
 |
||
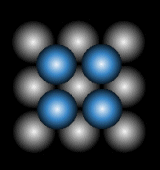
| 2層目(B) | ||
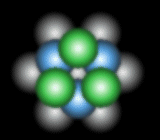 |
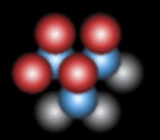 |
|
| 3層目(C) | 3層目(A=1層目) | |
| Face Center Cubic 構造 | Hexagonal Close Packed 構造 | |
| ABC-ABC ・・・ 積層 | AB-AB ・・・ 積層 | |
| 面心立方構造 | 六方最密構造 | |
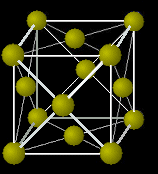 |
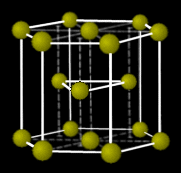 |
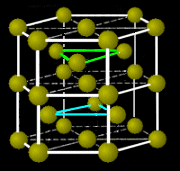 |
| fcc 構造 | hcp 構造 | ランタン 型 |
アルカリ金属や方向性の強いd軌道の外殻電子が結合に関与する原子番号の大きい金属がしばしばこの構造をとります。(Li、K、・・・、V、Cr、Mo、W、・・・など)
 |
 |
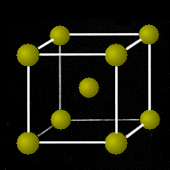 |
| 1層目 | 2層目 | bcc構造 |
最外殻電子として、d電子を持つ遷移金属の構造をまとめました。
元素記号 Sc Ti V Cr Mn Fe Co Ni Cu Zn 原子番号 21 22 23 24 25 26 27 28 29 30 結晶構造 hcp hcp bcc bcc * bcc hcp fcc fcc hcp 電子
配置M 3d 1 2 3 5 5 6 7 8 10 10 N 4s 2 2 2 1 2 2 2 2 1 2 元素記号 Y Zr Nb Mo Tc Ru Rh Pd Ag Cd 原子番号 39 40 41 42 43 44 45 46 47 48 結晶構造 hcp hcp bcc bcc hcp hcp fcc fcc fcc hcp 電子
配置N 4d 1 2 4 5 5 7 8 10 10 10 O 5s 2 2 1 1 2 1 1 0 1 2 元素記号 Lu Hf Ta W Re Os Ir Pt Au Hg 原子番号 71 72 73 74 75 76 77 78 79 80 結晶構造 hcp hcp bcc bcc hcp hcp fcc fcc fcc ** 電子
配置O 5d 1 2 3 4 5 6 7 9 10 10 P 6s 2 2 2 2 2 2 2 1 1 2
このように原子番号とともに周期的に構造が変化する様子は、結晶のもつ d-電子数と全電子エネルギーとの関係を計算することで説明が可能です。 「電子構造」についてはこちらで説明しています ⇒ [#]
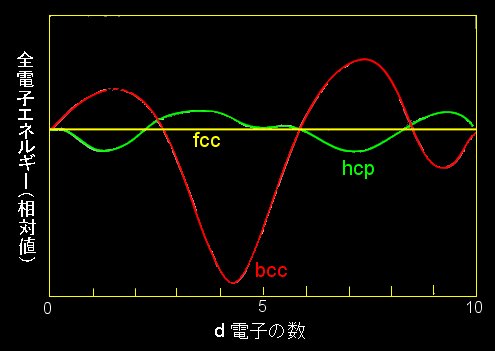
この図は概略(フリーハンド)です。正確な図は次の文献[1]を参照してください。
[1] D.G.Pettifor, J.Phy. C3, 376 (1970).